卵巢(ovary)(图19-1-1)是一对椭圆形的实质性器官,表面被覆单层立方或单层扁平上皮,称表面上皮,上皮下方为一层致密结缔组织,新鲜时呈白色,称白膜。卵巢实质分为周边的皮质和中央的髓质,两者无明显分界。皮质较厚,含有不同发育阶段的卵泡、黄体、白体和闭锁卵泡等结构,这些结构之间充填有大量梭形基质细胞和网状纤维的结缔组织基质。髓质范围较小,为疏松结缔组织,含有较多的血管、淋巴管和神经。近卵巢门处除有较大的血管和神经出入外,还有少量门细胞(hilus cell),其结构和功能类似睾丸间质细胞,可分泌雄激素。

图19-1-1 卵巢结构模式图
卵巢结构和功能有明显的年龄变化。表面上皮在幼年期为单层立方或单层柱状,随着年龄的增加而逐渐变为单层扁平,为青春期排卵做准备。原始卵泡的数量在新生儿双侧卵巢中有100万~200万个,幼年时有30万~40万个,青春期减少至4万个左右,到更年期时仅剩几百个。自青春期起,在垂体分泌的促卵泡激素(FSH)和黄体生成素(LH)作用下,卵巢中周期性的卵泡发育、成熟、排卵、黄体形成和转归过程,所分泌的雌激素和孕激素,调节子宫内膜的周期性生理活动。到更年期,卵巢功能逐渐减退,月经渐停,进入绝经期。绝经期后的卵巢不再排卵,卵巢内结缔组织增生,表面常凹凸不平(视频19-1-1)。
视频19-1-1 卵巢
卵泡(ovarian follicle)呈球团状,是由中央的一个卵母细胞(oocyte)和包绕在其周围的单层或多层卵泡细胞(follicular cell)构成。卵泡(图19-1-2)在发育和成熟过程中,结构发生一系列的变化,一般可分为四个阶段:原始卵泡、初级卵泡、次级卵泡和成熟卵泡。初级卵泡和次级卵泡阶段,合称为生长卵泡(growing follicle)。

图19-1-2 各级卵泡结构模式图
1.原始卵泡(primordial follicle)位于卵巢皮质浅层,数量最多,体积最小,是处于相对静止状态的卵泡。原始卵泡(图19-1-3)由中央一个初级卵母细胞(primaryoocyte)和周围单层扁平的卵泡细胞(follicular cell)构成。初级卵母细胞为圆形,体积较大,直径为30~40 μm,胞质嗜酸性,核大而圆,染色浅,核仁大而明显。电镜下可见胞质中有板层状排列的滑面内质网(称为环层板)、线粒体和高尔基复合体等。初级卵母细胞是胚胎时期由卵原细胞(oogonium)分裂分化而成,并长期停滞在第一次减数分裂前期,直至排卵前才完成第一次减数分裂。卵泡细胞呈扁平形,体积小,核扁圆色深,与结缔组织间有薄层基膜。卵泡细胞具有支持和营养卵母细胞的作用,二者之间通过缝隙连接进行物质信息的传递。
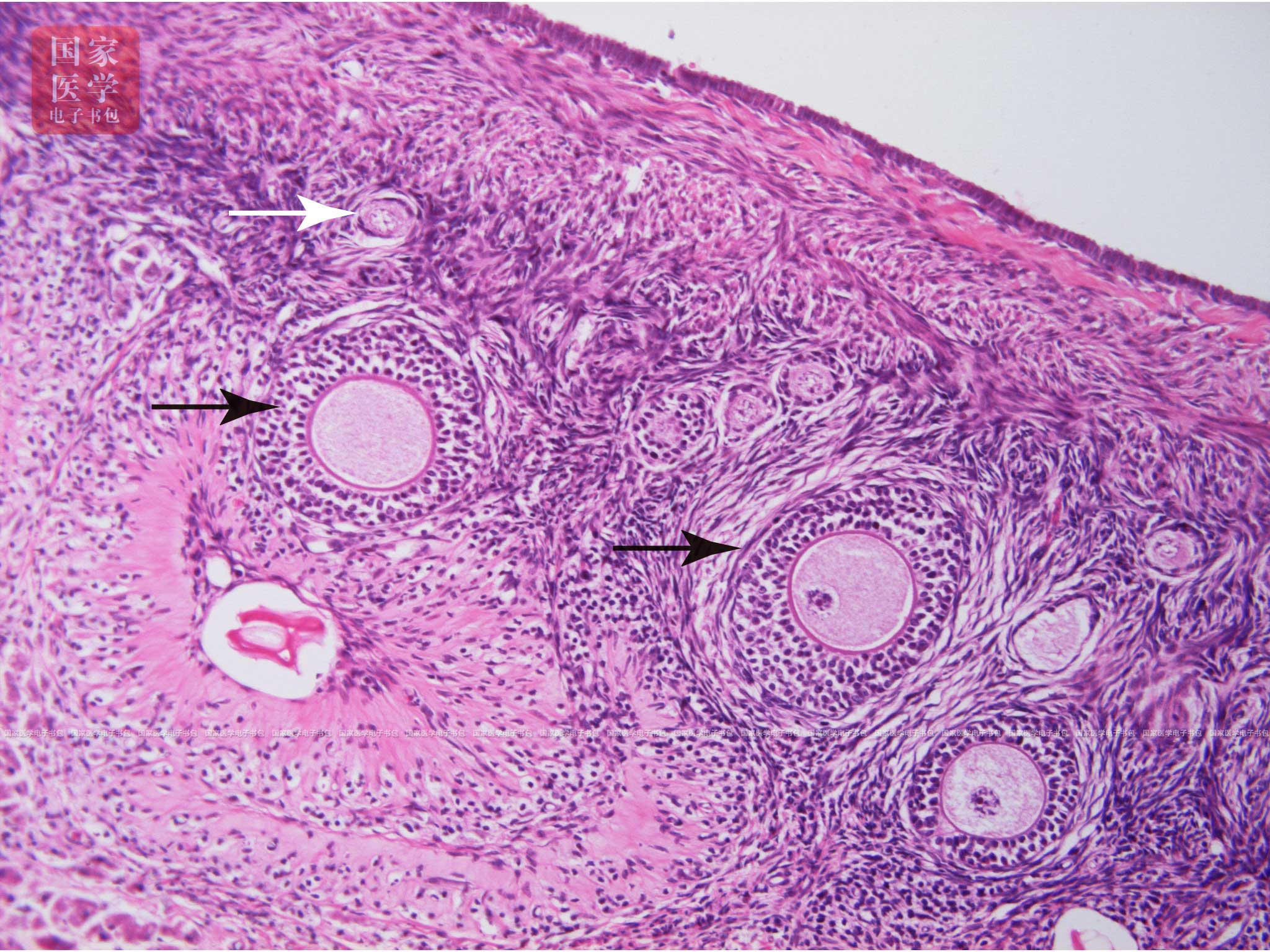
图19-1-3 原始卵泡和初级卵泡光镜图
2.初级卵泡
从青春期开始,在促卵泡激素(FSH)的作用下,部分静止的原始卵泡开始生长发育为初级卵泡(primary follicle)。初级卵泡(图19-1-3)由中央的一个初级卵母细胞和周围单层或多层的卵泡细胞组成。它的主要结构特点是:①初级卵母细胞体积增大;细胞核也变大,呈泡状,核仁深染;胞质内的粗面内质网、游离核糖体和高尔基复合体等细胞器增多;在靠近质膜的细胞质中出现电子
致密的溶酶体,称皮质颗粒(cortical granule),其所含的酶类在受精过程中发挥重要作用。②卵泡细胞由单层扁平变为单层立方或柱状,进而细胞增殖分裂为多层(5~6层)。此时,卵泡细胞之间逐渐形成一些散在的圆形小囊泡,称为考尔-爱克斯诺小体(Call-Exner body),内含卵泡细胞分泌的少量液体,参与卵泡液的形成。考尔-爱克斯诺小体的数量随卵泡的生长而增多。③在初级卵母细胞与周围的卵泡细胞之间出现一层均质且折光性强的嗜酸性薄膜,呈PAS阳性,称透明带(zona pellucida, ZP)(图19-1-4)。它由卵母细胞和卵泡细胞共同分泌形成。现已证明,构成透明带的糖蛋白至少有三种,即ZP1、ZP2和ZP3,其中ZP3为精子受体,对受精过程中卵细胞与精子的相互识别和特异性结合具有重要意义。电镜下,初级卵母细胞的微绒毛和卵泡细胞的细长突起分别伸入透明带,在微绒毛和突起之间可见桥粒和缝隙连接。缝隙连接有利于卵泡细胞将营养物质输送给卵母细胞,并且有利于细胞之间交换离子、激素和小分子物质,沟通信息,协调功能。④随着初级卵泡的增大,卵泡周围的结缔组织梭形细胞逐渐密集形成卵泡膜(theca folliculi),它与卵泡细胞之间以基膜相隔。卵泡细胞间未出现液腔。
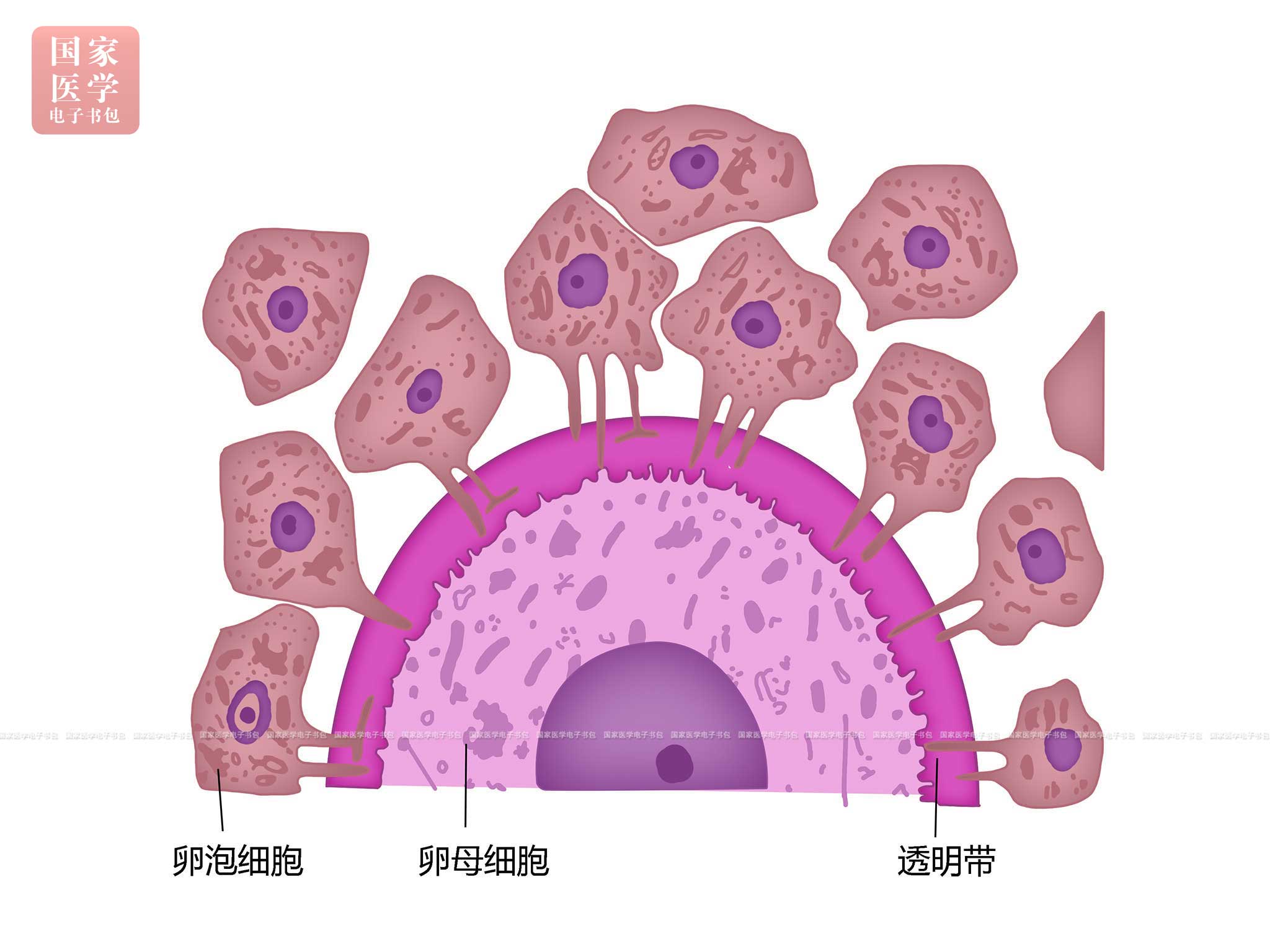
图19-1-4 透明带模式图
3.次级卵泡
在FSH的作用下,初级卵泡继续发育,体积逐渐增大,向皮质深部迁移,并在卵泡细胞之间出现液腔,称为次级卵泡(secondary follicle)(图19-1-5)。次级卵泡的结构特点是:①初级卵母细胞的体积发育达到最大,为125~150 µm,以后不再长大。②卵泡细胞继续增殖分裂,层数增多至6~12层。卵泡细胞之间出现一些大小不等的腔隙,随着卵泡的发育增大,逐渐合并为一个较大的腔,称卵泡腔(follicular cavity),腔内充满卵泡液,由卵泡细胞分泌的糖胺多糖和卵泡膜血管渗出的血浆组成,内含营养物质(如血浆蛋白、透明质酸等)、促性腺激素、雌激素及生长因子等多种生物活性物质,对卵泡的发育成熟具有重要作用。③随着卵泡液的增多和卵泡腔的扩大,初级卵母细胞、透明带及周边部分卵泡细胞被推向卵泡腔一侧,形成一个圆形隆起突入卵泡腔,称为卵丘(cumulus oophorus)。紧靠透明带的一层高柱状卵泡细胞呈放射状排列,称为放射冠(corona radiata)。分布在卵泡腔周边的数层卵泡细胞称为颗粒层(granulosa layer),此时,卵泡细胞改称颗粒细胞(granulosa cell)。④卵泡膜逐渐分化为内、外两层:内膜层,毛细血管丰富,基质细胞分化为多边形或梭形的膜细胞(theca cell),具有类固醇激素分泌细胞的特征;外膜层,血管少,以环形排列的胶原纤维和少量平滑肌细胞构成。
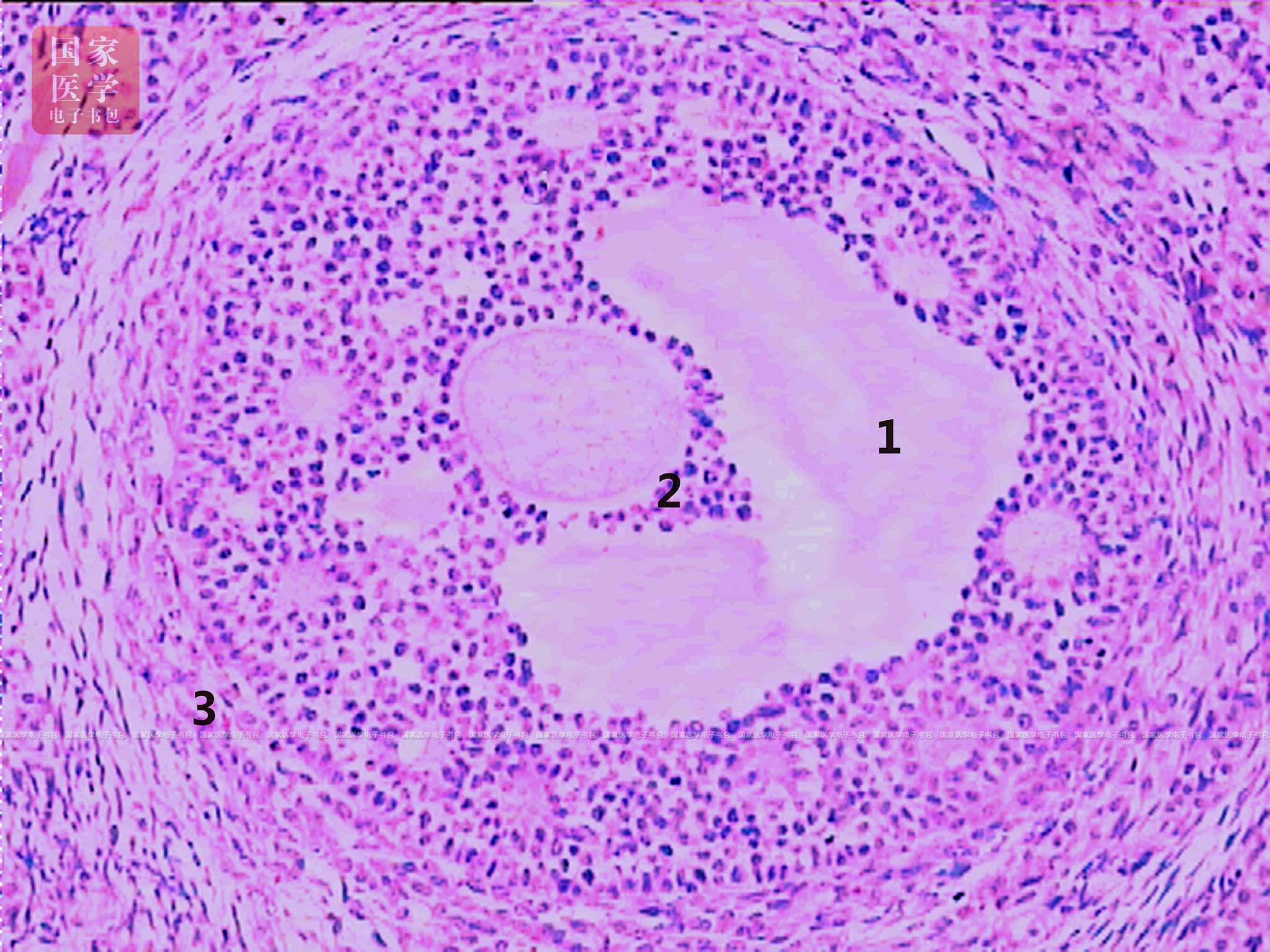
图19-1-5 次级卵泡光镜图
4.成熟卵泡
在FSH和LH的共同作用下,次级卵泡发育为成熟卵泡(mature follicle)(图19-1-6),是卵泡发育的最后阶段。卵泡体积很大,直径可达20 mm,并向卵巢表面突出。由于卵泡腔增大、颗粒细胞不再增殖,使卵泡壁越来越薄。在排卵前36~48 h,初级卵母细胞完成第一次减数分裂,形成次级卵母细胞(secondary oocyte)和第一极体(first polar body)。第一极体位于次级卵母细胞与透明带之间的卵周隙(perivitelline space)内。紧接着,次级卵母细胞迅速进入第二次减数分裂,并停滞在分裂中期。具有卵泡腔的次级卵泡和成熟卵泡又称为囊状卵泡(vesicular follicle)。成熟卵泡在排卵前直径达15~25 mm,又称格拉夫卵泡(Graafian follicle)或排卵前卵泡(preovulatory follicle)。从青春期开始,在FSH和LH作用下,从一个原始卵泡发育为成熟卵泡,并非在一个月经周期内完成,整个过程需85~90 d。在一个月经周期里有十余个卵泡生长发育,一般只有一个卵泡发育至成熟并排卵,其余卵泡均在不同发育阶段闭锁形成闭锁卵泡。女性一生排卵400~500个。绝经期后,排卵停止。
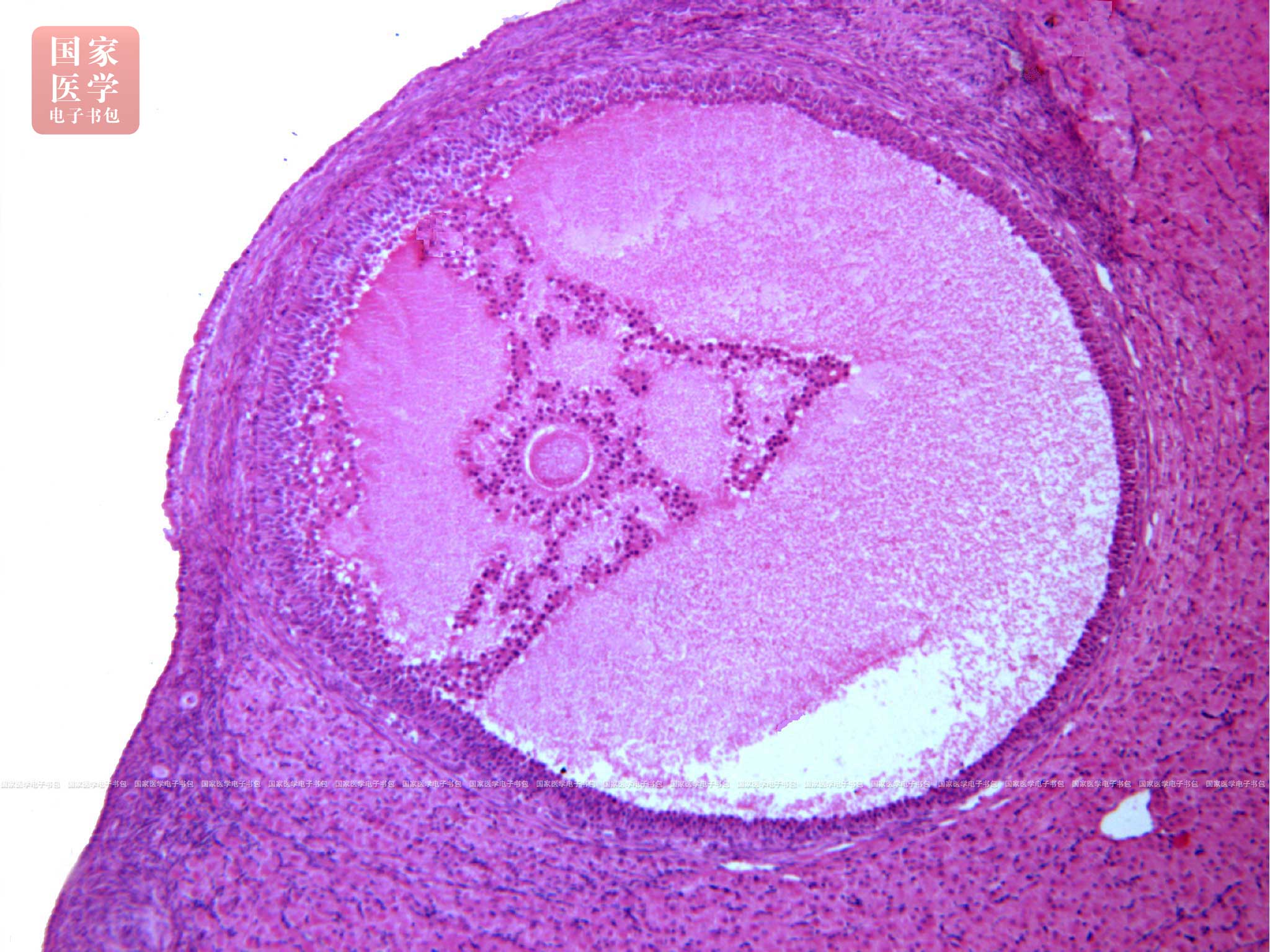
图19-1-6 成熟卵泡光镜图
次级卵泡和成熟卵泡具有内分泌功能,主要合成雌激素。雌激素的合成是卵泡膜细胞和颗粒细胞分别在FSH和LH的作用下协同完成的。膜细胞合成的雄激素透过基膜进入颗粒细胞,在颗粒细胞内芳香化酶系作用下将雄激素转化为雌激素(图19-1-7)。雌激素小部分进入卵泡液,大部分进入血液循环,调节子宫内膜等靶器官的生理活动。
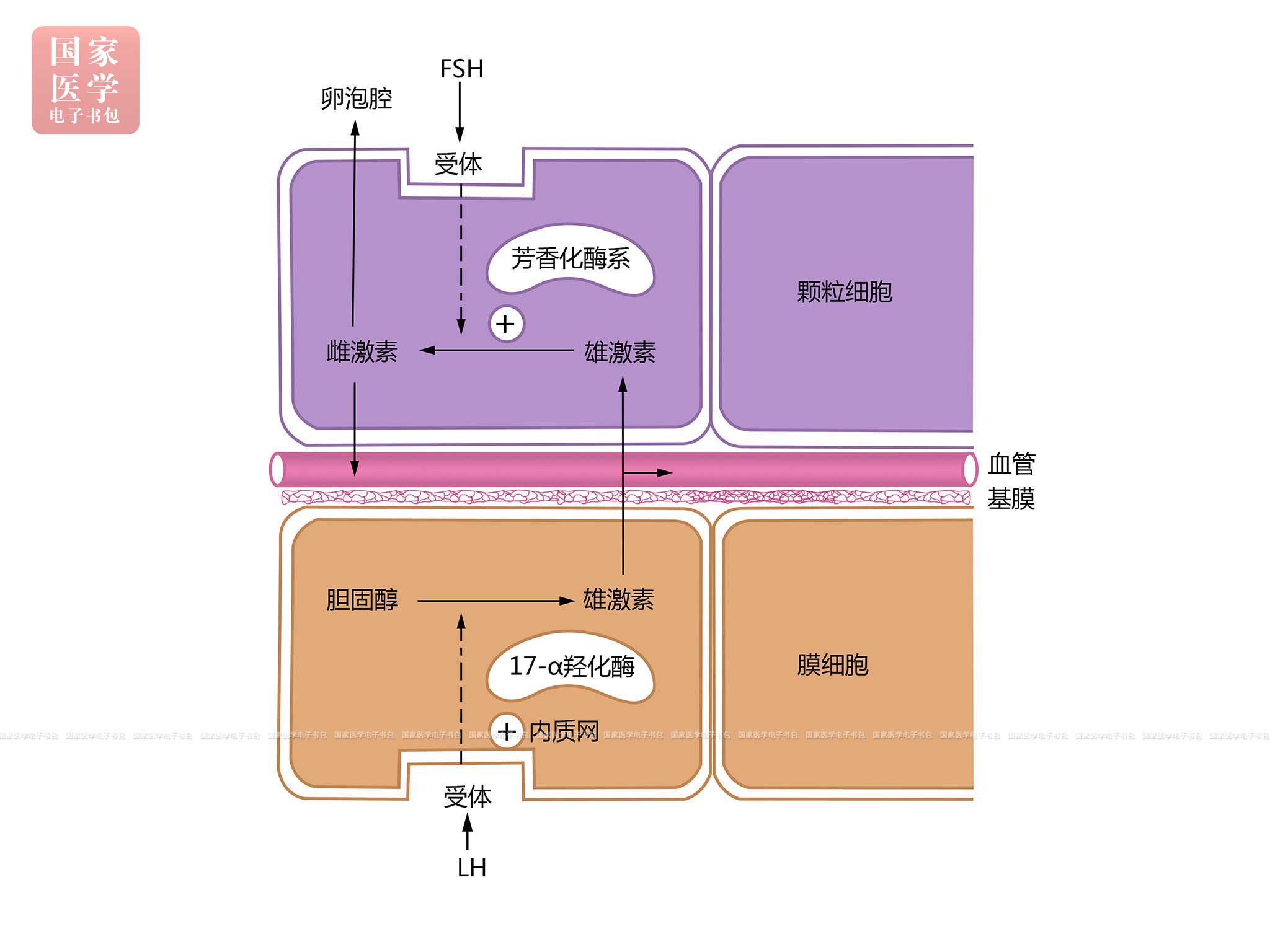
图19-1-7 雌激素合成过程示意图
排卵
成熟卵泡破裂,卵丘从卵巢排出的过程称排卵(ovulation)。排卵时间约在月经周期的第14天。排卵前,垂体释放大量LH,成熟卵泡内的卵泡液剧增,卵泡壁变薄,卵泡突出卵巢表面,白膜和表面上皮变得更薄,局部缺血,形成一圆形透明的卵泡小斑(follicular stigma)(图19-1-8)。继而,小斑处的组织被蛋白水解酶和胶原酶分解,在LH的作用下颗粒细胞合成的前列腺素使卵泡膜外层的平滑肌收缩,最终卵泡小斑破裂,漂浮于卵泡液中的卵丘(包括次级卵母细胞及其周围的透明带和放射冠)随卵泡液一同从卵巢排出,经腹腔进入输卵管。次级卵母细胞若在排出后24 h之内未受精则退化,若受精则完成第二次减数分裂而形成一个成熟的卵细胞(ootid)和一个小的第二极体(secondary polar body)。卵母细胞经过两次减数分裂,卵细胞的染色体数目减半,从二倍体细胞(46,XX)变为单倍体细胞(23,X)。生殖期妇女一般每隔28 d左右排一次卵,两侧卵巢交替进行。
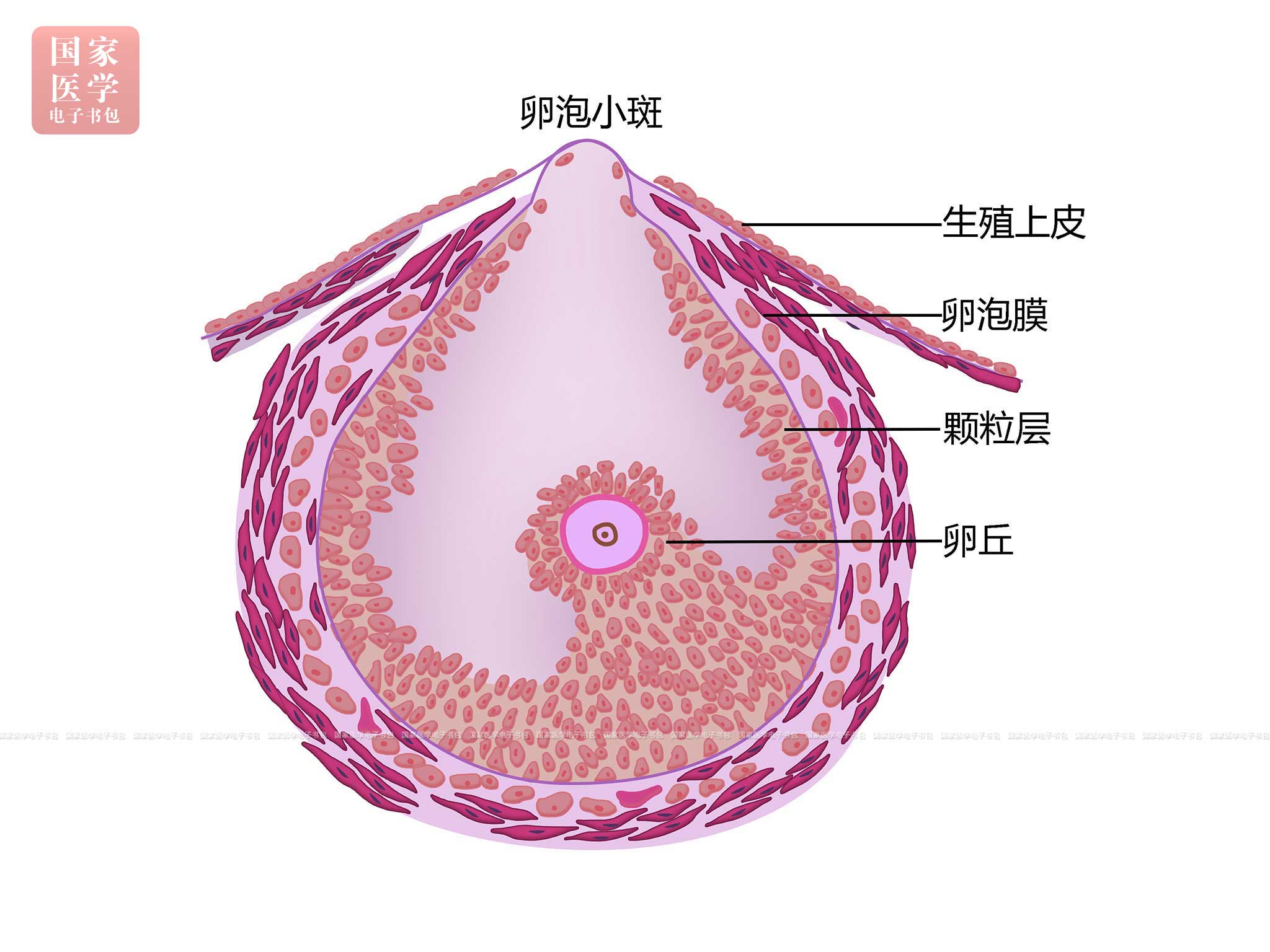
图19-1-8 成熟卵泡排卵前示意图
闭锁卵泡
退化的卵泡称闭锁卵泡(atretic follicle)(图19-1-9)。卵泡闭锁可发生在卵泡发育的任何阶段,是一种细胞凋亡的过程,各期闭锁卵泡的形态结构各不相同,但最后都将被中性粒细胞和巨噬细胞吞噬。早期的卵泡闭锁后,逐渐消失,不留痕迹。当闭锁发生于次级卵泡或成熟卵泡时,其中的初级卵母细胞退化消失;透明带先皱缩为不规则形的嗜酸性环状物,后退化消失;颗粒细胞松散,脱落入卵泡腔,细胞凋亡;卵泡膜细胞增大,形似膜黄体细胞,被结缔组织和血管分隔为分散的细胞团索,称间质腺(interstitial gland)。人卵巢间质腺较少,猫和啮齿类动物卵巢间质腺较多。间质腺能分泌雌激素。
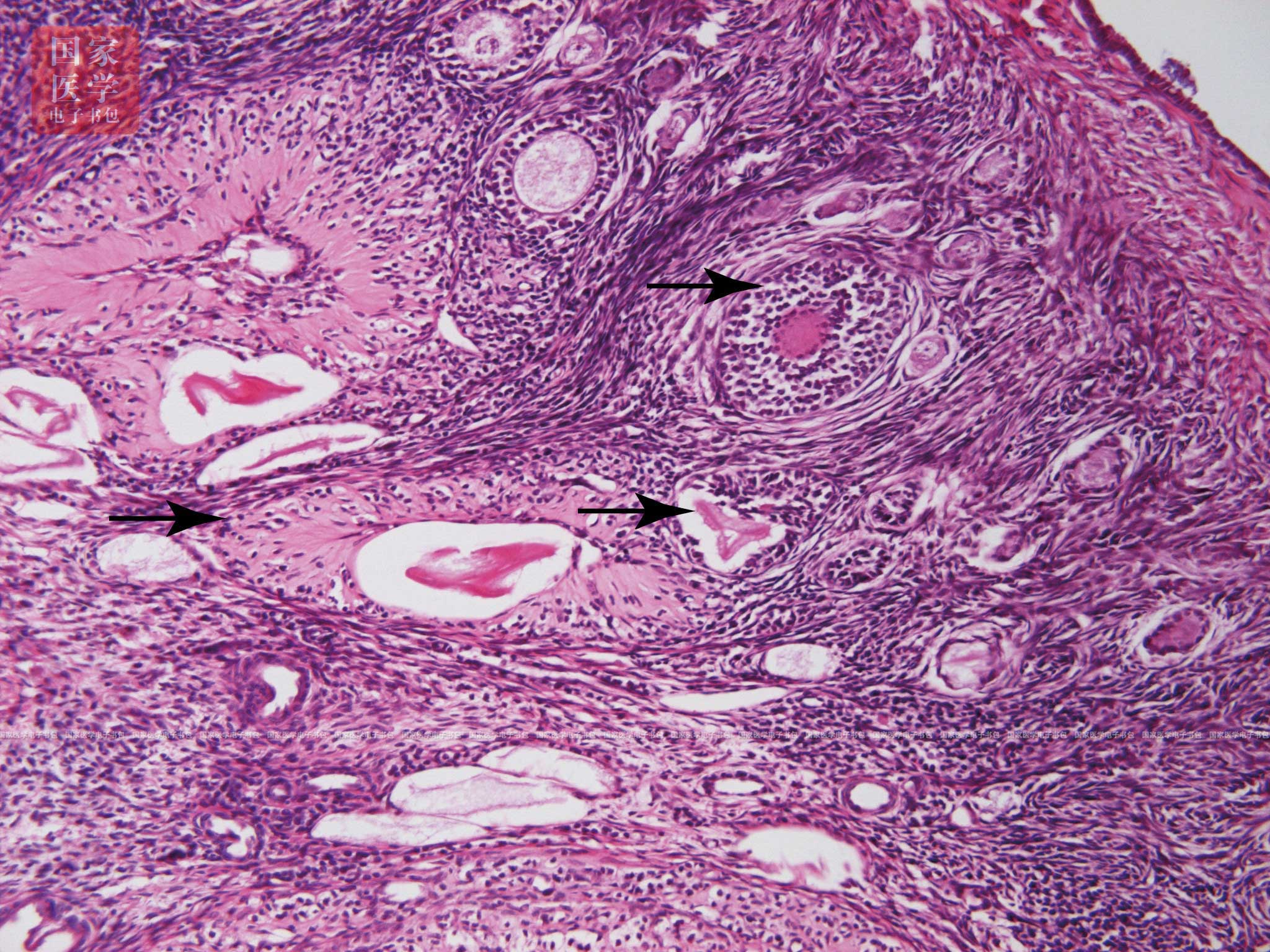
图19-1-9 闭锁卵泡光镜图









